2025-06-11
Cell Regeneration | Breaking Traditional Barriers: Deep Learning Unlocks a New Dimension in Cellular Mechanics
Cell Regen | 突破传统瓶颈!深度学习解锁细胞力学新维度
细胞力学特性是反映细胞表型和功能的关键生物物理标志物,在揭示细胞行为机制、解析疾病发生发展规律以及推动细胞治疗产品研发方面具有不可替代的核心价值。然而,目前基于原子力显微镜(AFM)的单细胞力学评估方法存在显著局限性:一方面,其检测通量严重受限,每小时仅能获取数十个细胞的力学数据;另一方面,由于设备操作复杂且技术门槛较高,难以实现大规模细胞样本的快速筛查,这一技术瓶颈严重制约了相关领域的研究进程和临床应用转化。
针对这一亟待解决的瓶颈问题,近日,清华大学生物医学工程学院杜亚楠教授课题组在Cell Regeneration期刊上发表了题为 “Image-based evaluation of single-cell mechanics using deep learning”的研究论文,创新性地提出了一种基于深度学习技术的单细胞刚度评估方法。该方法利用明场细胞图像,实现了在单细胞水平对细胞刚度的高效、精准评估,为细胞力学特性研究及临床转化提供了极具潜力的创新工具,有望突破传统检测技术的局限,为细胞力学研究领域注入新的活力,推动相关研究迈向新高度。
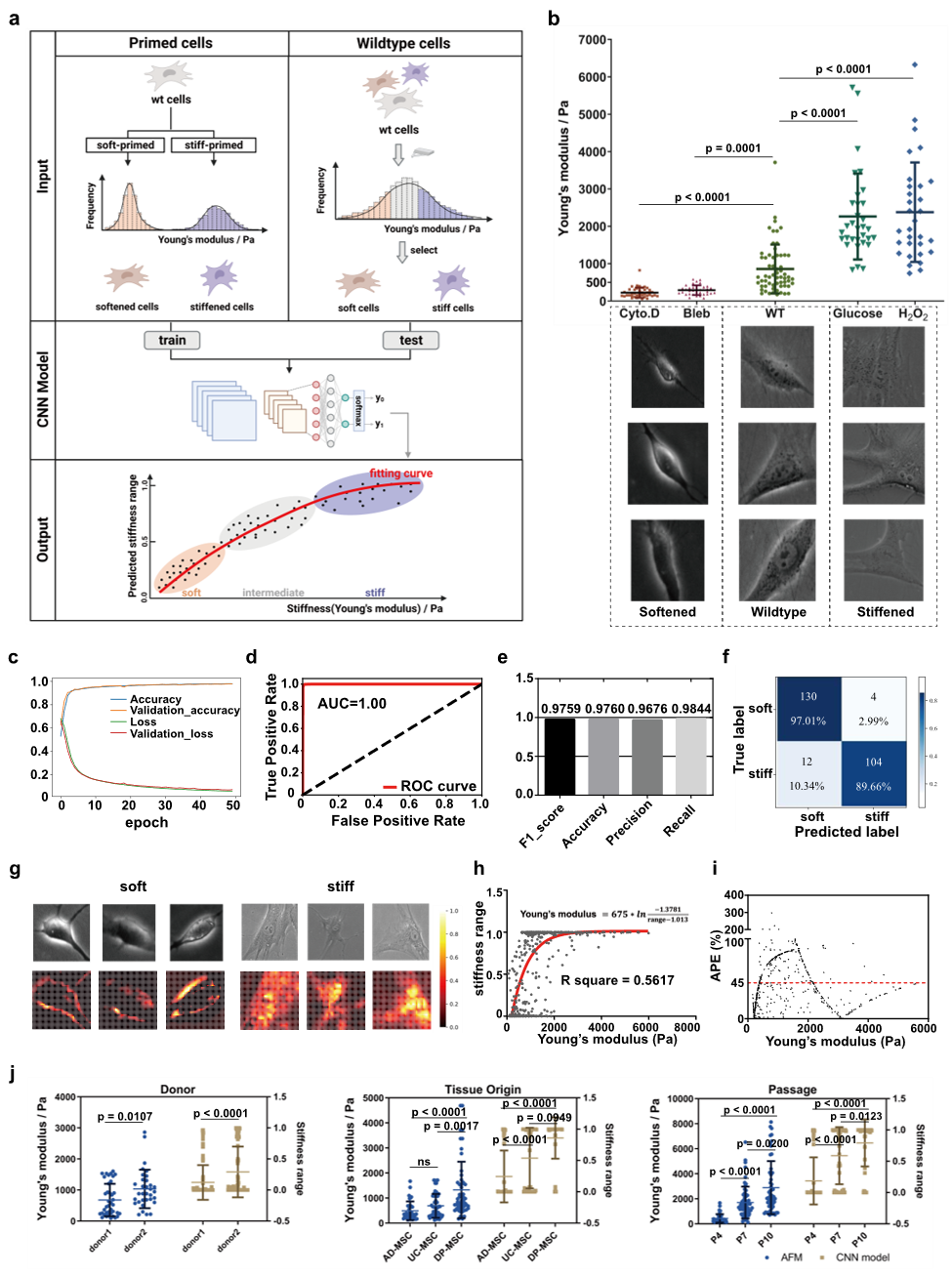
图1 刚度分类模型与分类效果
本研究创新性地提出了一种基于深度学习的细胞刚度评估方法,通过构建卷积神经网络(CNN)分类模型,实现了对间充质干细胞(MSCs)和RAW264.7巨噬细胞刚度的高效、准确分类,并进一步探索了细胞刚度与功能的关联。研究者首先利用不同化合物处理MSCs,生成涵盖200 Pa至3 kPa刚度范围的亚群细胞图像数据集,并分别获得超6万张较软MSCs和较硬MSCs单细胞图像。构建的CNN刚度分类模型在测试集上表现出色,AUC达1.00,F1分数0.9759,准确率0.9760。该模型不仅能够定量预测野生型MSCs刚度范围,且与原子力显微镜(AFM)测量值的平均绝对百分比误差相近,表现出良好的可靠性。
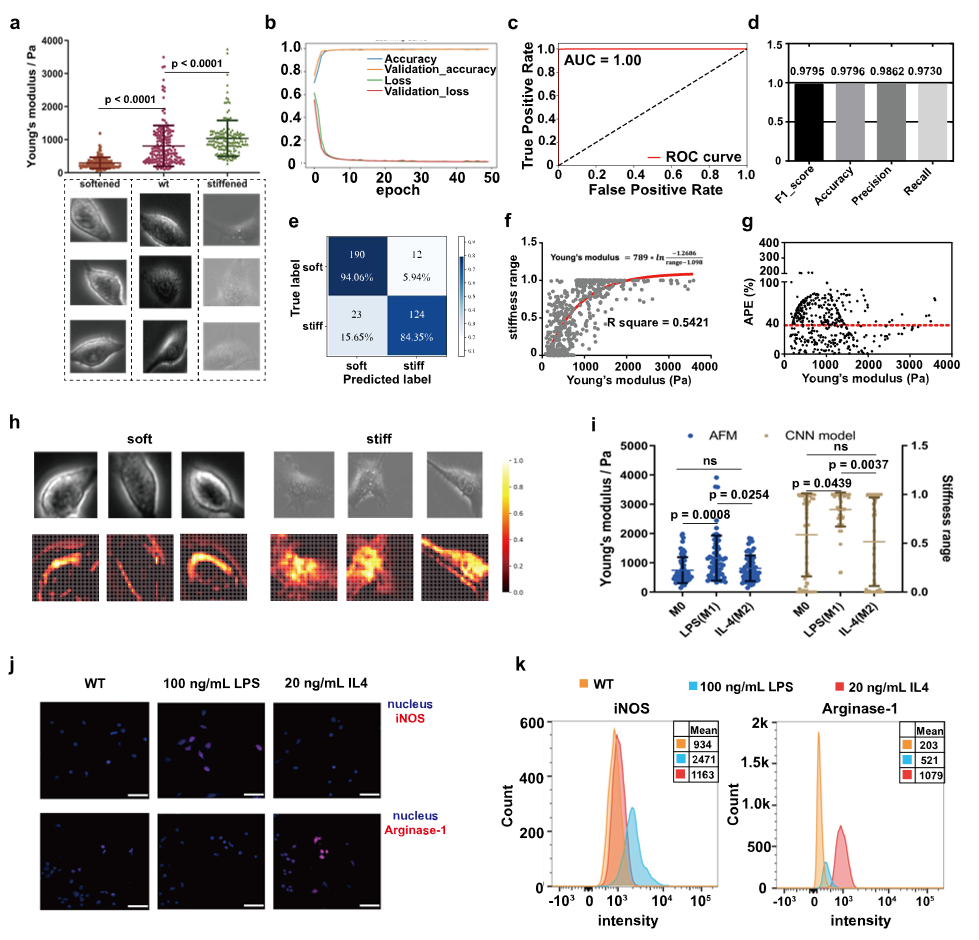
图2 RAW264.7刚度分类模型
为进一步验证刚度分类模型的通用性,研究者选用RAW264.7巨噬细胞系进行实验。通过处理获得约200±100 Pa的软细胞亚群和约2±1 kPa的硬细胞亚群,最终分别收集超6万张软硬单细胞图像构建数据集。训练所得的CNN刚度分类模型在测试集上表现同样强劲,AUC达1.00,且与AFM测量值的平均绝对百分比误差也显示出良好的一致性。这一结果表明,基于深度学习的细胞类型特异性刚度分类模型可用于不同细胞类型的刚度评估。
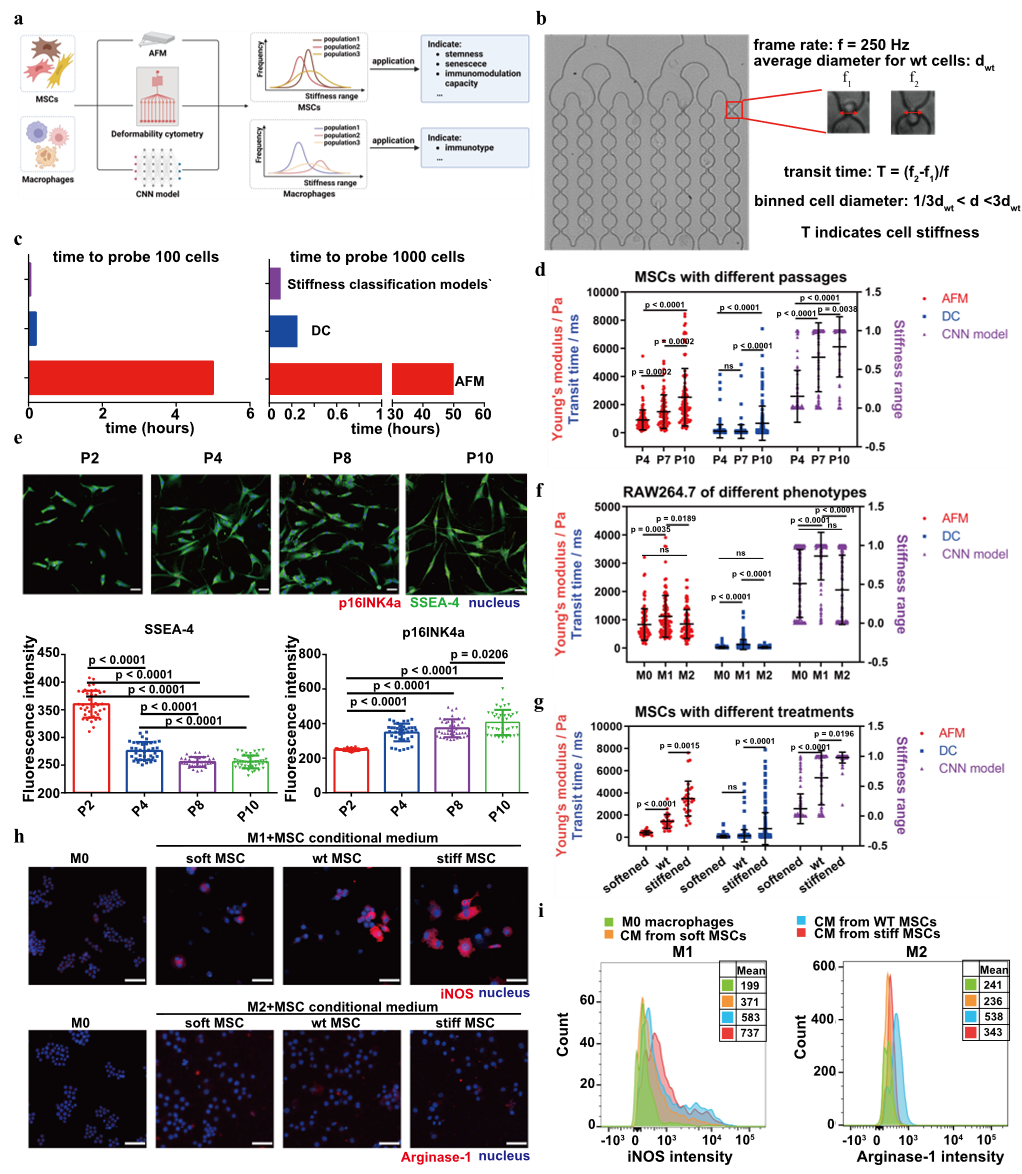
图3 刚度分类模型比较与功能研究
研究者还将刚度分类模型与细胞形变测量仪(Deformability cytometry, DC)及AFM技术从效率和准确性方面进行对比。在MSCs不同传代研究中,三种方法均显示细胞刚度随传代增加而升高,但DC未能准确检测到所有不同代次MSCs的刚度差异。在刚度相关的功能研究中进一步分析发现,MSC刚度与干性及衰老水平和其免疫调控水平密切相关。而在巨噬细胞研究中,三种方法评估结果一致显示M1表型巨噬细胞刚度高于M0和M2表型。这些结果表明,CNN刚度模型具有研究细胞功能的良好前景。
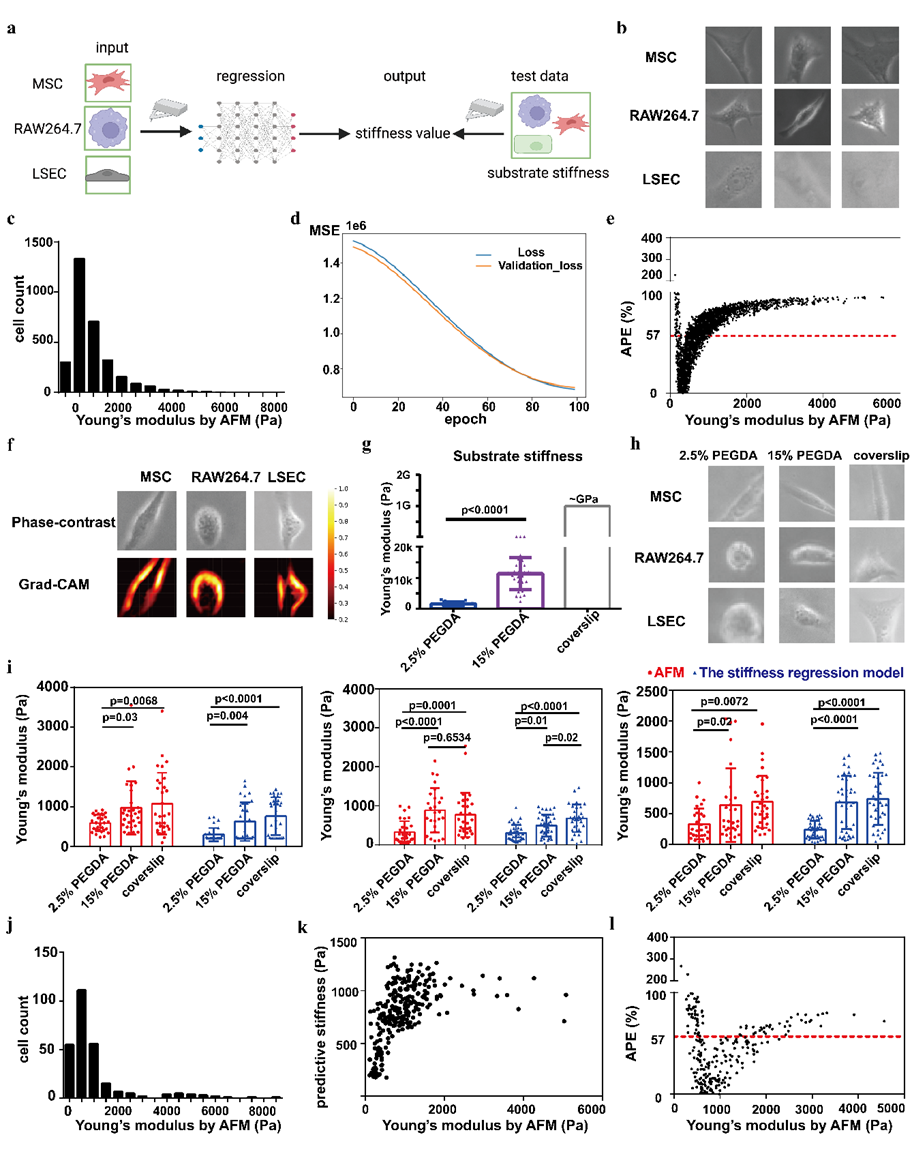
图4 刚度回归模型和效果
在刚度分类模型的基础上,研究者进一步构建更精细的预测模型,开发了基于深度学习的回归模型,用于跨细胞类型直接预测杨氏模量。该数据集包含1149个MSCs、1237个RAW264.7细胞和939个肝窦内皮细胞(LSECs)的图像,单细胞实际杨氏模量均由AFM测量获得。模型训练时采用均方误差(MSE)作为损失函数,平均绝对百分比误差(APE)为57%。模型能够预测不同刚度基底上培养细胞的刚度差异,表明其具备一定跨细胞类型评估细胞刚度差异的预测能力,为未来扩大数据集和优化模型架构以提升预测性能提供了概念验证。

图5 基于深度学习的刚度模型研究思路
综上所述,本研究通过构建CNN分类模型,实现了对MSCs和RAW264.7细胞刚度的高效、准确分类,并探索了细胞刚度与功能的关联。进一步的回归模型概念验证研究显示,尽管数据集有限,仍可预测细胞的刚度差异。未来,随着数据集的扩大、模型的优化及更多细胞类型和力学特性的探索,基于深度学习的图像评估模型有望在生物医学领域发挥更大作用,推动细胞治疗产品的标准化和功能评估。
清华大学生物医学工程学院杜亚楠教授为本文通讯作者,清华大学生物医学工程学院2017级博士生吴钊钊和清华大学基础医学院2022级博士生冯亦婷为共同第一作者,清华大学生物医学工程学院陈慧军教授和清华大学基础医学院石彦教授为论文工作做出了重要贡献。本研究获得多项国家自然科学基金资助支持。
通讯作者
杜亚楠,博士生导师,现任清华大学生物医学工程学院教授。杜亚楠教授在“微组织工程”这一特色交叉研究方向进行创新探索,实现理论探究和技术转化。开发的3D微组织技术可作为新一代细胞药物的扩增制备平台和药剂学递送系统革新体外细胞培养和再生医学;同时可辅助建立仿生生理/病理模型,用于高通量药物筛选和病理机制研究。发表多篇高影响力论文,相关微组织工程产品已经商品化,并获得美国FDA和中国药监局相关资质。为再生医学、药物开发和病理研究提供新型平台技术、理论模型和解决方案。

DOI: https://doi.org/10.1016/j.engmed.2024.100038

