2023-04-11
Nature Biomedical Engineering
杜亚楠课题组解析并重建肝硬化瘢痕组织中高级糖化终产物介导的胶原交联及异常生物力学微环境
肝纤维化发展而来的肝硬化已成为全球排名第十三和我国排名第十的致死性疾病,后期极易转化为肝癌,而每年肝癌患者的死亡数在我国高达约40万,占全世界肝癌患者死亡数的约一半。肝硬化缺乏有效临床治疗手段,硬化肝组织内形成高度交联的细胞外基质是肝硬化难于治疗的重要原因之一。已有大量研究希望通过干预赖氨酰氧化酶(Lysyl Oxidase,LOX)介导的胶原交联反应抑制瘢痕组织的形成,从而治疗肝硬化,但在临床试验中均未取得理想治疗效果。这说明目前对于肝硬化细胞外基质的研究尚不充分。肝脏是重要的糖代谢器官,肝硬化导致肝组织内糖代谢异常,并且约30%的肝硬化患者会并发糖尿病,提示以还原糖(例如葡萄糖)为驱动的高级糖化终产物(Advanced Glycation End-products,AGE)交联反应与硬化肝组织中高交联的胶原瘢痕的重要潜在联系。深入探究交联反应对硬化肝组织中胶原瘢痕形成的作用,有望揭示肝硬化疾病发生的机制、并为临床治疗提供新的潜在靶点。
2023年4月10日,清华大学医学院杜亚楠教授课题组在Nature Biomedical Engineering (《自然:生物医学工程》)期刊发表题为“Advanced glycation end-products as mediators of the aberrant crosslinking of extracellular matrix in scarred liver tissue” (高级糖化终产物介导纤维化肝组织中细胞外基质的异常交联反应)的研究论文。研究首次发现“高度AGE交联的胶原基质是肝硬化的重要病理特征”。通过体内定量和体外重构AGE交联的胶原基质模型,揭示了AGE交联可显著改变胶原纤维的结构和力学特性,导致异常的生物物理微环境,调控细胞的表型和功能。同时表明抑制AGE交联反应可潜在抑制胶原瘢痕的形成,缓解肝纤维化进程。
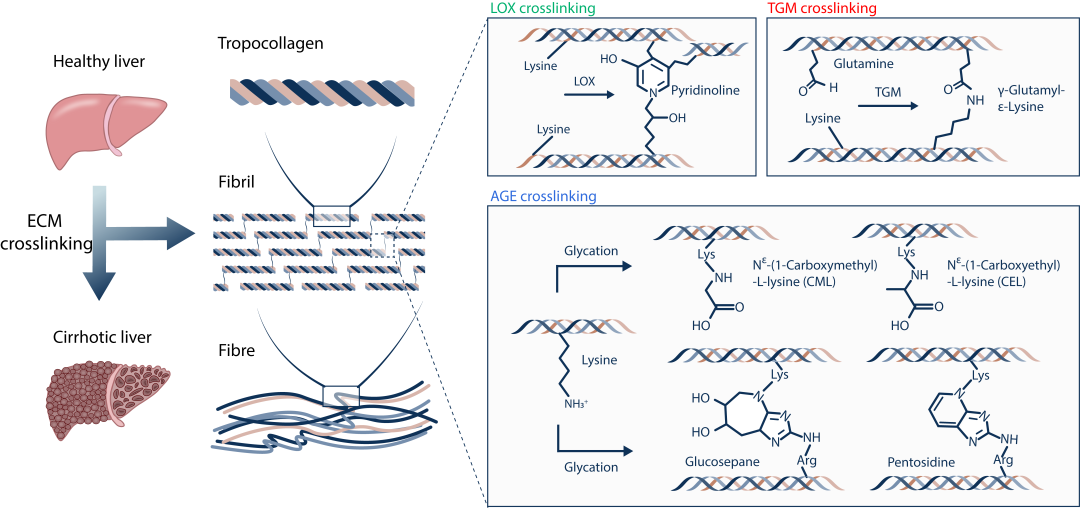
图1. 肝硬化发生过程中LOX, TGM, 和AGE介导的交联反应可以促进形成高交联的胶原瘢痕组织。交联反应在原胶原分子及胶原纤维之间形成新的交联键。所形成的高交联胶原瘢痕组织具有更强的力学特性,并难以被蛋白酶降解。LOX交联(绿色)主要形成以Pyridinoline为代表的交联键;TGM交联(红色)主要形成以γ-Glutamyl-ε-Lysine为代表的交联键;AGE交联(蓝色)主要形成以CML,CEL,GLucosepane,Pentosidine为代表的交联键。
本研究首先探究了可能参与肝硬化组织中高交联瘢痕组织形成的多种交联反应1,2,例如由赖氨酰氧化酶(Lysyl Oxidase, LOX),谷氨酰胺转移酶(Transglutaminase,TGM)和高级糖基化产物(Advanced Glycation End-products, AGE)介导的交联反应 (图1)。为了精准探究细胞外基质(Extracellular Matrix,ECM)的交联特征,避免肝组织内细胞组分及代谢产物对交联度定量分析的影响,团队通过优化组织去细胞化技术,有效分离了健康及硬化肝组织的细胞外基质,并结合液相色谱-质谱联用的方案,开发了针对细胞外基质交联度的绝对定量方法(Absolute Quantification of Matrix-specific Crosslinking, AQMC)。 借此方法首次证明高度AGE交联的肝脏细胞外基质是肝硬化的重要病理特征,并且在临床肝硬化组织样本及两种不同的肝纤维化动物模型中证明了该结论(图2)。定量分析结果显示AGE交联在形成胶原瘢痕的过程中,可能比LOX交联和TGM交联反应机制发挥了更显著的作用。
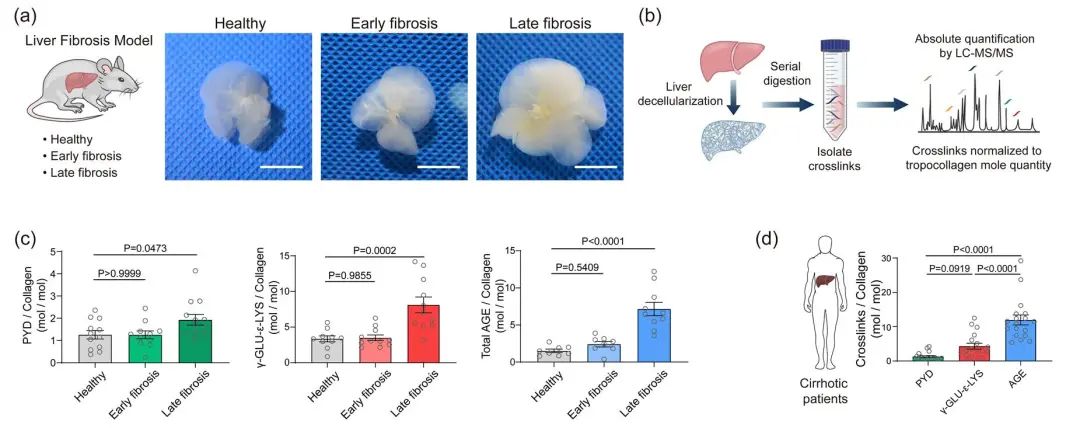
图2. 定量肝组织细胞外基质的交联特征。(a)小鼠肝组织去细胞化;(b)使用AQMC方法定量细胞外基质交联度;(c)定量检测小鼠纤维化肝组织的细胞外基质交联度;(d)定量检测临床肝硬化病人肝组织细胞外基质交联度。结果表明肝硬化的肝脏细胞外基质具有很高的AGE交联度,说明AGE交联是形成胶原瘢痕组织的重要交联方式。
为了揭示 AGE 交联作用对细胞外基质的影响,研究团队在体外构建了具有不同交联度的 AGE 交联胶原基质,从力学粘弹性、结构参数、交联度等方面重现了体内肝纤维化发展过程中细胞外基质的病理特征。借助冷冻电镜和光镊技术,首次从单根胶原纤维的维度阐释了 AGE 交联反应对胶原基质的影响,发现 AGE 交联会导致相邻纤维之间相互缠绕、集结成束、形成粗大的纤维束结构,导致其应力松弛速率降低,从而导致 AGE 交联的胶原纤维更难被细胞产生的外力重构(图3)。
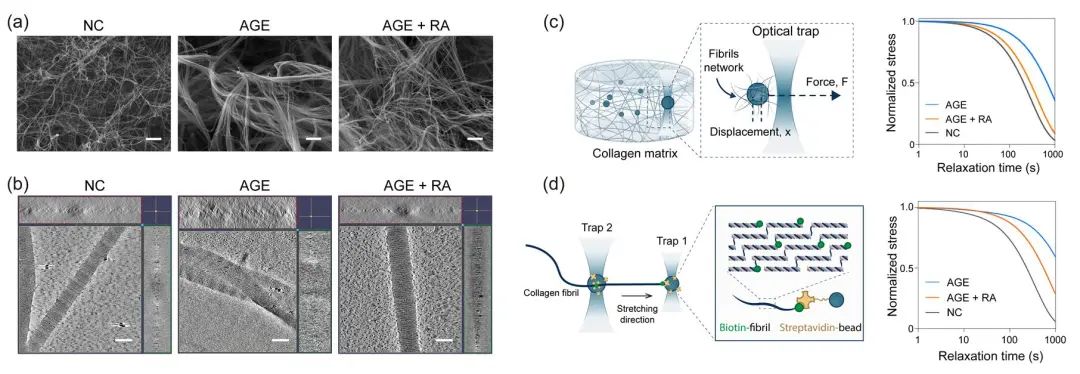
图3. AGE交联对胶原基质的结构和粘弹性的影响。(a)体外构建的胶原基质模型的扫描电镜图像;(b)胶原纤维的冷冻电镜三维重建图像;(c)单光阱光镊技术检测整体胶原基质粘弹性;(d)双光阱光镊技术检测单根胶原纤维的粘弹性。
研究团队前期结果表明肝脏组织内细胞外基质介导的“旁张力”生物力学信号会调控细胞行为,并进一步加剧纤维化进展3,4。这提示了AGE交联可能通过改变胶原基质的性质,参与到这一生物力学调控过程中。巨噬细胞对肝纤维化疾病具有重要调控作用,且其表型和功能易受细胞外基质的影响而改变5。本研究探究了AGE交联的胶原基质对巨噬细胞的调控作用。体外实验表明,在 AGE 交联胶原基质中生长的巨噬细胞,对周边胶原纤维的募集、重构程度下降,细胞-基质粘附分子减少、细胞骨架组装程度降低、组蛋白去乙酰化酶 3(Histone Deacetylase 3, HDAC3)表达降低。该力学信号调控导致巨噬细胞的 I 型免疫响应减弱,II 型免疫响应增强,从而潜在地促进纤维化进程。通过在体外胶原基质模型中进行筛选验证,发现小分子化合物迷迭香酸(Rosmarinic Acid, RA)可以抑制AGE交联。在小鼠的晚期肝纤维化模型中,迷迭香酸干预也可以有效抑制形成高度 AGE 交联的细胞外基质,并且有助于缓解肝纤维化的程度(图4)。
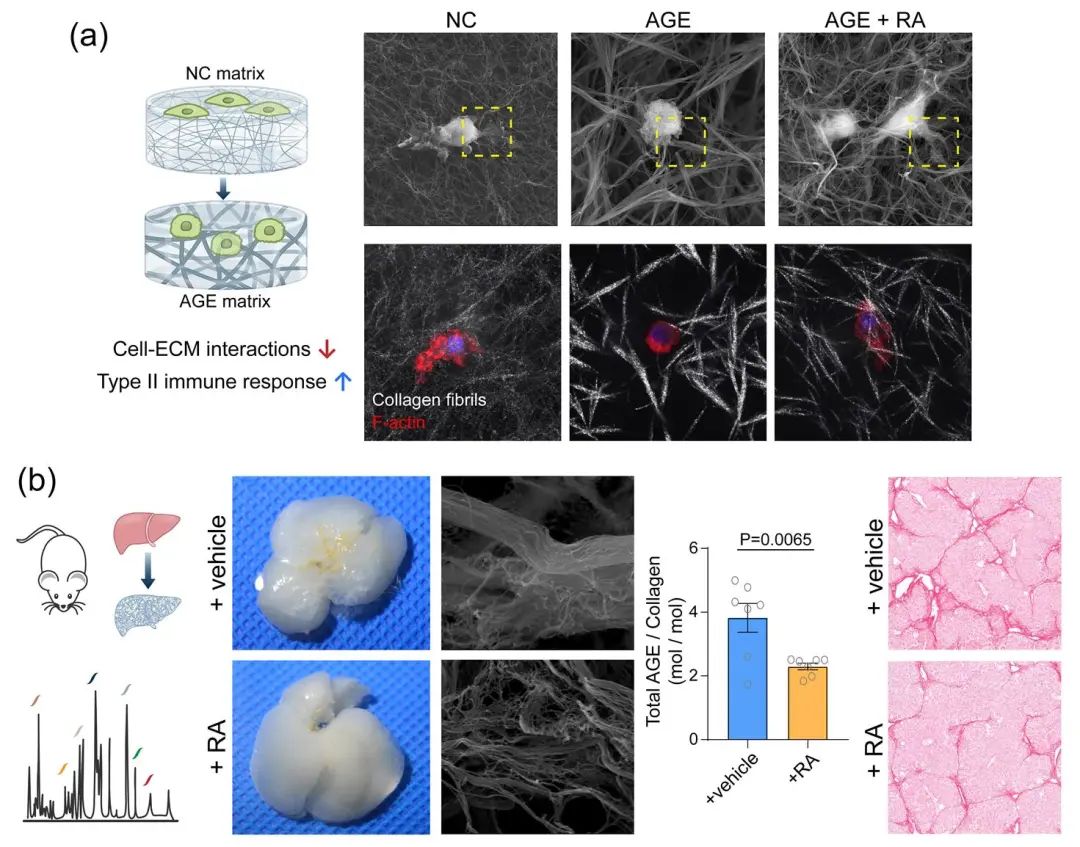
图4. (a)AGE交联改变胶原基质生物力学性质,通过力学信号调控作用影响巨噬细胞的表型和免疫应答功能;(b)迷迭香酸可以抑制肝纤维化过程中形成高度AGE交联的细胞外基质。
综上,针对肝硬化缺乏有效疗法的临床需求,受到肝硬化常伴随糖代谢异常这一临床观察的启发,本研究通过开发解析组织细胞外基质交联度的精准定量方法,首次发现了高度 AGE 交联是肝硬化细胞外基质的重要病理特征。并借助体外重构的仿生模型,从单根胶原纤维层面证明了 AGE 交联对胶原纤维结构、功能的影响以及产生的异常生物力学信号对巨噬细胞的调控作用,揭示了 AGE 交联促进纤维化疾病发生的潜在机制 (图5)。研究结果为纤维化疾病的病理研究和鉴定提供了有力工具,为临床诊断和干预多种器官和组织纤维化/硬化提供了新思路和潜在靶标,具有重要的科学研究及临床指导意义。
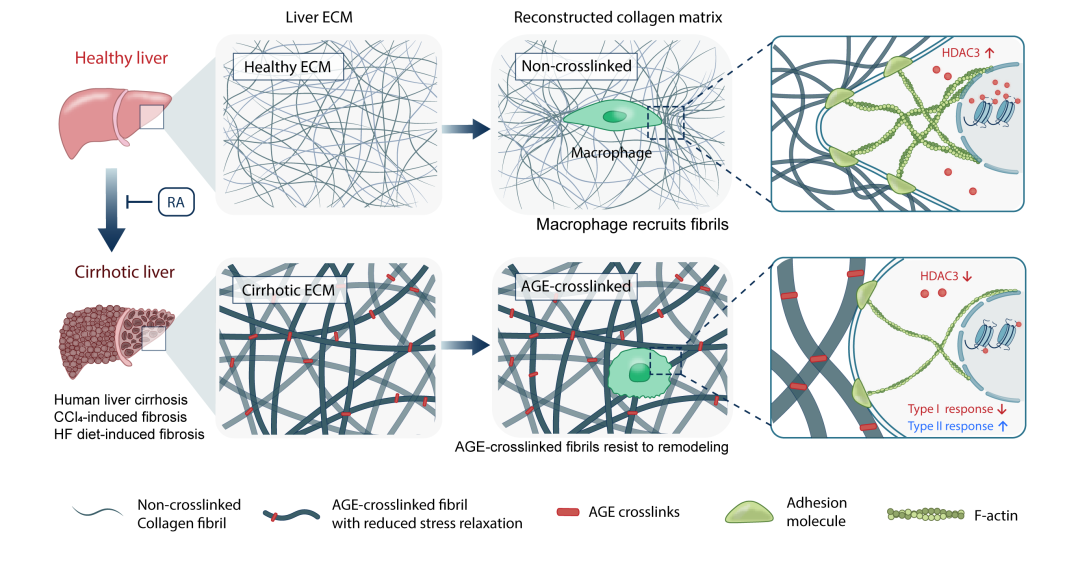
图5. 研究思路及结论示意图。
清华大学医学院生物医学工程系教授、生命科学联合中心研究员杜亚楠为该文章的通讯作者,清华大学医学院生物医学工程系博士吕丞、医学院博士生孔文瑜为共同第一作者,医学院博士生刘志强、赵鹏、牛宇迪、梁恺倪、王思涵对本研究有重要贡献。清华大学医学院胡小玉教授,清华大学生命学院李雪明副教授对本研究有重要指导。北京清华长庚医院肝胆胰外科项灿宏主任、杨威医生对临床样本研究提供了重要帮助。该研究得到了国家杰出青年科学基金(82125018)的支持。
原文链接:
DOI:https://doi.org/10.1038/s41551-023-01019-z
NBME News DOI:https://doi.org/10.1038/s41551-023-01119-w
杜亚楠实验室发表的相关参考文献:
[1] Lyu C, Kong W, Liu Z, Wang S, Zhao P, Liang K, Niu Y, Yang W, Xiang C, Hu X, Li X, Du Y. Advanced glycation end-products as mediators of the aberrant crosslinking of extracellular matrix in scarred liver tissue. Nature Biomedical Engineering. 2023. DOI: 10.1038/s41551-023-01019-z (https://www.nature.com/articles/s41551-023-01019-z)
[2] Kong W, Lyu C, Liao H, Du Y. Collagen crosslinking: effect on structure, mechanics and fibrosis progression. Biomedical Materials. 2021, 16(6).
[3] Liu L, You Z, Yu H, Zhou L, Zhao H, Yan X, Li D, Wang B, Zhu L, Xu Y, Xia T, Shi Y, Huang C, Hou W, Du Y. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 2017, 16(12): 1252-1261.
[4] Liu L, Yu H, Zhao H, Wu Z, Long Y, Zhang J, Yan X, You Z, Zhou L, Xia T, Shi Y, Xiao B, Wang Y, Huang C, Du Y. Matrix-transmitted paratensile signaling enables myofibroblast-fibroblast cross talk in fibrosis expansion. PNAS. 2020, 117(20): 10832-10838.
[5] Jiang S, Lyu C, Zhao, P., Li W, Kong W, Huang C, Genin GM, Du Y. Cryoprotectant enables structural control of porous scaffolds for exploration of cellular mechano-responsiveness in 3D. Nature Communications. 2019, 10(1): 3491.

