2021-12-20
清华大学医学院杜亚楠课题组应邀在Trends in Cell Biology综述纤维化进程中的机械通讯
2021年11月19日,清华大学医学院杜亚楠研究团队应邀在国际知名学术期刊"细胞生物学进展"(Trends in Cell Biology)发表题为"纤维化进程中的机械通讯"(Mechanical communication in fibrosis progression)的综述文章,此文同时被收录于Science Direct的《微系统和机械生物学》(Microsystems and Mechanobiology)论文集中。本文将作为Trends in cell biology期刊2022年1月刊封面文章。该文系统总结了近年来三种机械通讯范式(细胞-细胞外基质,细胞-血流动力学,细胞-细胞外基质-细胞,图1)对各类器官组织(心脏、肝脏、肺)纤维化疾病进程调控作用的最新研究进展。同时,研究人员对构建纤维化微环境的工程手段、预测与解析微环境内力学调控通路的建模方法进行了系统总结,并在此基础上提出潜在靶向生物力学机械通讯范式的新型纤维化疾病治疗手段和策略。


全球工业化国家目前45%的死亡由纤维化疾病所致。纤维化是在损伤信号下组织修复与重塑的过程,涉及到细胞、胞外基质和血流动力学等多种因素,可导致器官功能衰竭。纤维化过程中机械微环境的改变既是纤维化的结果,也是促进纤维化的原因。因此,细胞如何在与细胞外基质和血流的互作过程中感受并传递生物力学信号是亟待深入探究的重要机制。
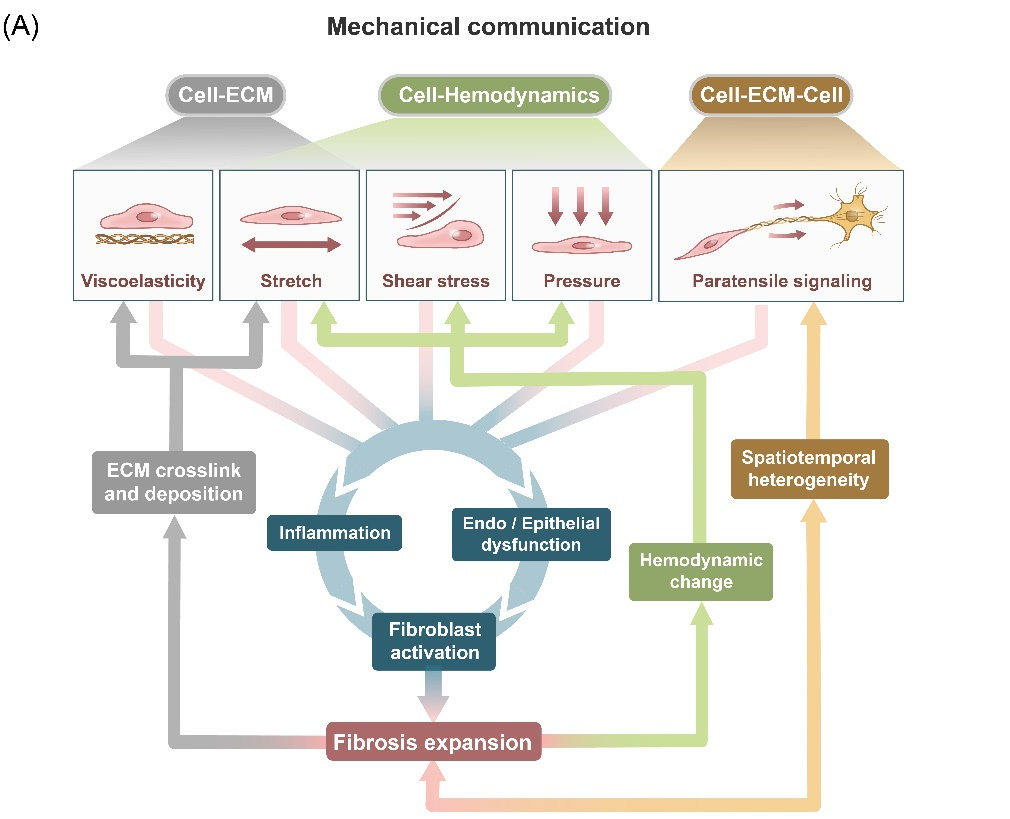
图1. 纤维化进展过程中的机械通讯范式
细胞外基质的非线性力学特征是调控细胞功能的重要因素(图2)。纤维化进展过程中细胞外基质成分和粘弹性的变化可导致成纤维细胞的激活。具有高弹性与低粘性的胞外基质可通过整合素-细胞骨架、TGFβ受体、机械力敏感离子门控通道-钙离子-YAP/TAZ等力学信号通路增强α-SMA表达,促进细胞外基质沉积与重塑,形成细胞外基质与细胞间的双向力学互作调控。
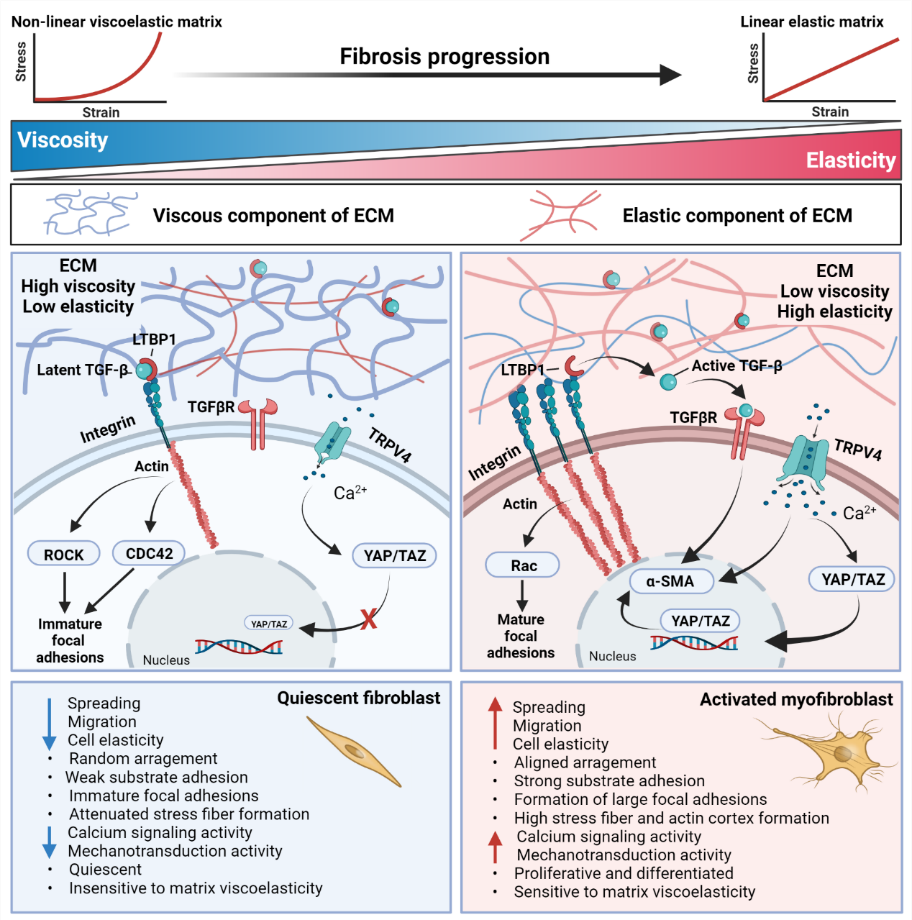
图2. 细胞-细胞外基质互作
微循环系统内细胞与血流动力学的交流互作对纤维化进程具有重要调控作用(图3)。正常生理条件下,微循环系统处于低血压、低剪切应力的环境,有利于维持血管屏障完整性与物质交换。由于纤维化过程中微血管数量、形态及细胞外基质力学性质的改变,微血管内产生压力、剪切力升高,牵张应力异常,扰动流的血流动力学特征变化,激活离子门控通道、G-蛋白偶联受体、糖萼、整合素等力学感受器与下游信号转导通路,造成微血管内皮细胞功能障碍,进一步导致成纤维细胞激活、免疫细胞激活、内皮细胞间质化、微血管血栓、血管屏障受损与通透性改变及血管新生等细胞功能及微环境变化,加剧血流动力学参数的异常化与纤维化发展,形成细胞-血流动力学间力学互作与纤维化的正反馈调节。
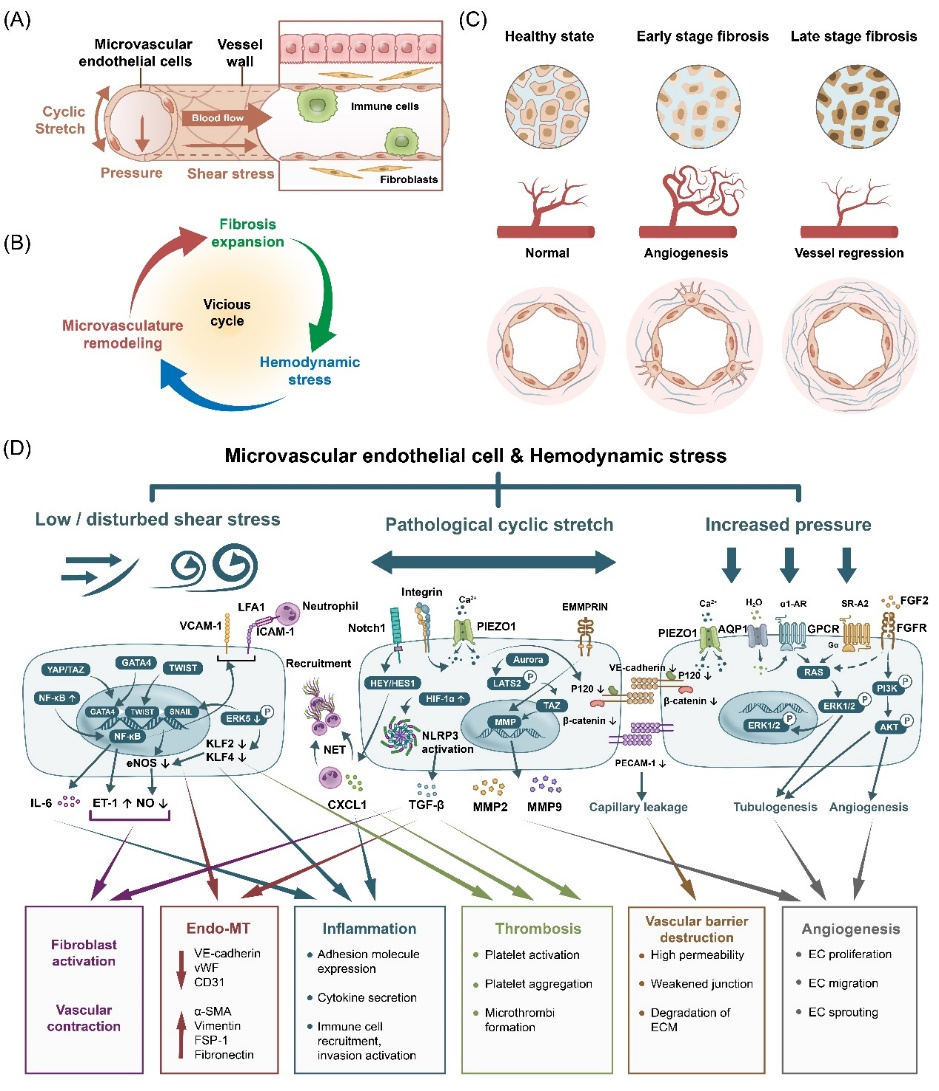
图3 细胞-血流动力学的互作(A) 微血管内皮细胞所处的血流动力学微环境 (B) 异常血流动力学参数-微血管重塑-纤维化进展形成正反馈循环 (C) 纤维化进展过程中的早期血管新生与晚期血管退化 (D) 纤维化微环境内血流动力学参数引起细胞力学传导调控的力学感受器与胞内通路
旁张力信号介导的细胞间机械通讯是一种纤维化发展蔓延过程中的新型细胞间通讯模式(图4)。2017年杜亚楠课题组在'Nature Materials'上首次报道了肝窦内皮细胞血管化产生的机械力可通过胶原纤维传导激活肝星形细胞从而促进肝纤维化的进程。该团队2020年发表于'PNAS'的研究进一步发现来源于不同组织(肝脏、心脏和皮肤)的成纤维细胞均可通过胶原纤维介导的旁张力信号导致临近成纤维细胞的激活与纤维化区域的扩张蔓延。同时,在不同环节阻断旁张力信号传导为临床干预纤维化疾病提供了新思路。近期,旁张力信号理论还被用于阐释皮肤瘢痕疙瘩无法完成正常皮肤组织愈合导致持续扩张的病理机制 (FASEB 2021)。
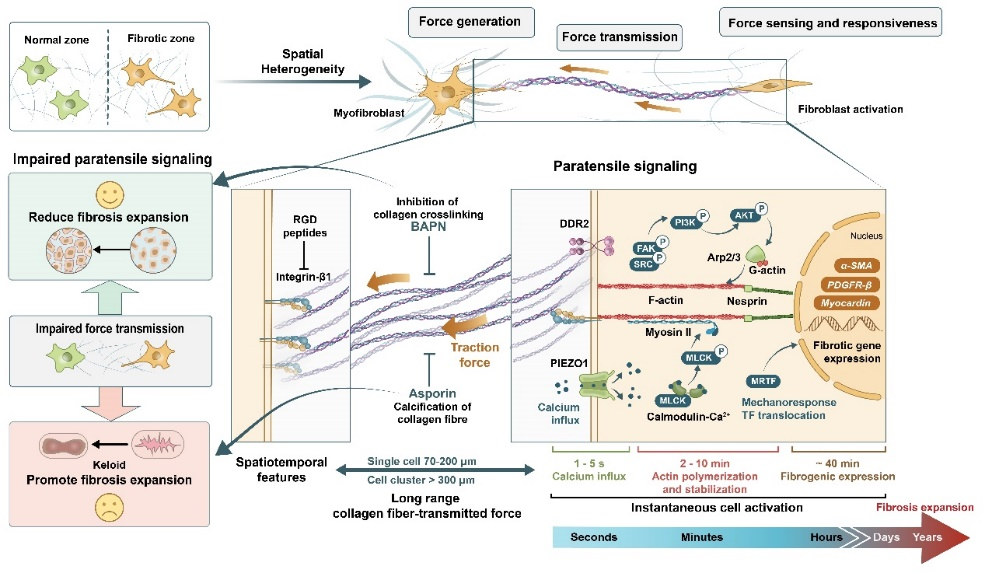
图4 旁张力信号介导的细胞间机械通讯
构建体外工程化微环境以模拟并解析纤维化扩张过程中的细胞与机械力通讯模式,对于深入理解疾病进程、开发针对性治疗药物具有重要意义(图5)。本文系统总结了体外从二维到三维、由静态至动态,实现基底力学性质与培养液流体力学参数调节的工程化微环境,可用于研究纤维化过程中机械通讯解析和药物筛选。同时,生理建模分析及理论预测的手段可辅助纤维化过程中生物力学参数测量、关键力学调控通路解析,助力基于力学交流互作范式的新型疗法的开发。除此之外,本综述中还展望了基于人类多能干细胞的组织工程、自动化微流体以及仿生材料等技术突破在体外重现纤维化组织(如肝血窦、心肌和肺泡)结构空间异质性的可能性;以及通过体外实验和计算虚拟筛选靶向不同机械通讯模式以实现纤维化治疗的潜在策略。
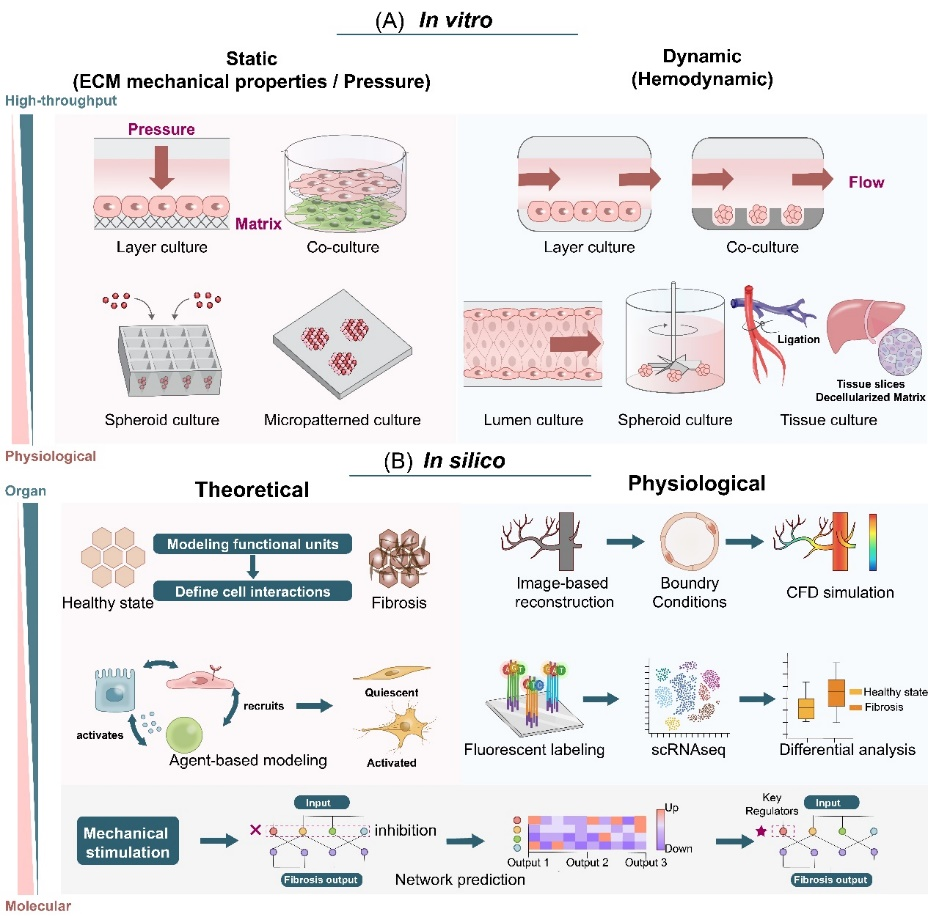
图5 研究与预测纤维化进展过程中机械通讯模式和力学转导通路的工程化微环境与理论模型
清华大学医学院生物医学工程系、清华-北大生命科学联合中心杜亚楠教授为本文通讯作者, 清华PTN项目2017级博士生龙艺和2020级生物医学工程系博士生牛宇迪为本文共同第一作者。2020级生物医学工程系硕士生梁恺倪做出重要贡献。本研究得到了国家自然科学基金(82061148010)、北京市自然科学技术委员会(JQ18022)的资助支持。
原文链接:
https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(21)00203-8
DOI:https://doi.org/10.1016/j.tcb.2021.10.002

